Structure et Liaison | Chimie organique 1
Structure atomique
X: Symbole de l'élément
Z: Numéro atomique = nombre de protons
A: Numéro de masse = nombre de protons + nombre de neutrons
Nombre de neutrons = A-Z
Nombre d'électrons = nombre de protons - charge
Z est toujours le même pour un élément spécifique
A peut être différent. et sont deux isotopes
Configuration électronique
Configuration électronique :
L'arrangement des électrons dans les orbitales atomiques d'un atome. Une orbitale atomique peut contenir au maximum 2 électrons.
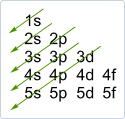
La configuration électronique d'un élément peut facilement être déterminée en utilisant le mnémonique ci-dessous. Les lignes diagonales donnent l'ordre des sous-couches. Le nombre maximum d'électrons dans chaque sous-couche est le suivant : 2 e- dans les sous-couches s, 6 e- dans les sous-couches p, 10 e- dans les sous-couches d, 14 e- dans les sous-couches f.
Oxygène ⇒ Z = 8 et l'atome neutre ⇒ 8 électrons ⇒ 1s22s22p4
Fer ⇒ Z = 26 et l'atome neutre ⇒ 26 électrons ⇒ 1s22s22p63s23p64s23d6
Liaisons ioniques et covalentes
La règle de l'octet:
La règle générale qui régit le processus de liaison pour les éléments de la deuxième période (les principaux éléments en chimie organique) : les atomes ont tendance à former des molécules de manière à atteindre un octet dans la couche électronique de valence et à atteindre une configuration de gaz noble.
Les liaisons ioniques vs. les liaisons covalentes
La liaison est un processus qui permet à deux atomes de se joindre et qui entraîne une diminution de l'énergie et une augmentation de la stabilité : les atomes acquièrent une couche externe complète d'électrons de valence. Il existe deux types principaux de liaisons :
- Les liaisons ioniques sont basées sur l'attraction électrostatique forte entre deux ions de charges opposées. Ces liaisons résultent du transfert d'électrons d'un élément à un autre afin de suivre la règle de l'octet
- Les liaisons covalentes sont des liaisons à deux électrons. Ces liaisons résultent du partage d'électrons entre deux atomes (en particulier ceux du milieu du tableau périodique). Les électrons sont partagés pour permettre aux atomes d'atteindre des configurations de gaz noble
Nombre attendu de liaisons covalentes autour d'un atome = 8 - nombre d'électrons de valence
Carbon: Z = 6 → 6 e- et neutre → 1s2 2s2 2p2 → 4 e- dans sa couche de valence
Le carbone a besoin de 4 électrons supplémentaires pour obtenir la configuration de Néon et formera donc 4 liaisons covalentes avec d'autres atomes → l'atome de carbone est tétravalentNitrogen: Z = 7 → 7 e- et neutre → 1s2 2s2 2p3 → 5 e- dans sa couche de valence
L'azote a besoin de 3 électrons supplémentaires pour obtenir la configuration de Néon et formera donc 3 liaisons covalentes avec d'autres atomes → l'azote est trivalent
Charge formelle
Charge formelle:
Charge attribuée aux atomes individuels dans une structure de Lewis
Charge formelle = nombre d'électrons de valence dans l'atome libre - nombre d'électrons de valence dans l'atome lié
Nombre d'électrons de valence dans l'atome lié = nombre d'électrons non liés + nombre d'électrons liés
Quelles sont les charges formelles dans la molécule CH3NO2 ?
N : 1s2 2s2 2p3 = [He] 2s2 2p3 ⇒ 5 électrons de valence dans l'atome libre
4 liaisons : 8 électrons partagés ⇒ 4 électrons de valence dans l'atome lié
Charge formelle = 5 - 4 = +1O : 1s2 2s2 2p4 = [He] 2s2 2p4 ⇒ 6 électrons de valence dans l'atome libre
2 liaisons + 2 paires non liantes : 4 électrons partagés + 4 électrons non liés ⇒ 6 électrons de valence dans l'atome lié
Charge formelle = 6 - 6 = 0O : 1s2 2s2 2p4 = [He] 2s2 2p4 ⇒ 6 électrons de valence dans l'atome libre
1 liaison + 3 paires non liantes : 2 électrons partagés + 6 électrons non liés ⇒ 7 électrons de valence dans l'atome lié
Charge formelle = 6 - 7 = -1
Hybridisation et géométrie
Hybridation:
La combinaison de 2 ou plusieurs orbitales atomiques pour former le même nombre d'orbitales hybrides:
- Hybridation sp3: la combinaison de 1 orbitale s et 3 orbitales p pour former 4 orbitales hybrides sp3
- Hybridation sp2: la combinaison de 1 orbitale s et 2 orbitales p pour former 3 orbitales hybrides sp2
- Hybridation sp: la combinaison de 1 orbitale s et 1 orbitale p pour former 2 orbitales hybrides sp
Géométrie:
Le nombre de domaines électroniques (atomes ou paires d'électrons isolées) autour d'un atome détermine sa géométrie et son hybridation:
- 2 domaines électroniques ⇒ linéaire (angle des liaisons: 180°) ⇒ hybridation sp
- 3 domaines électroniques ⇒ plan trigonal (angle des liaisons: 120°) ⇒ hybridation sp2
- 4 domaines électroniques ⇒ tétraédrique (angle des liaisons: 109,5°) ⇒ hybridation sp3
Formes de résonance
Les différentes formes de résonance d'une substance ne sont pas toutes équivalentes : la forme avec le plus de liaisons et moins de charges contribue davantage à l'hybride de résonance. Sélection de la meilleure structure de résonance qui contribue le plus à l'hybride de résonance :
- Des charges formelles plus basses (positives ou négatives) sont préférables aux charges plus élevées.
- Les charges formelles sur des atomes adjacents ne sont pas souhaitables.
- Une charge formelle plus négative doit résider sur un atome plus électronégatif.
2 isomères diffèrent par l'arrangement de leurs atomes et électrons, tandis que 2 structures de résonance diffèrent seulement par l'arrangement de leurs électrons.
Structures de Lewis
Structure de Lewis :
Une représentation de l'arrangement des atomes et de la position de tous les électrons de valence dans une molécule ou un ion polyatomique. Les paires d'électrons partagés sont représentées par des lignes entre 2 atomes, et les paires d'électrons isolées sont représentées par des paires de points sur les atomes individuels. Nous essayons toujours de satisfaire la règle de l'octet (ou la règle du duet pour l'hydrogène) lors de l'écriture des structures de Lewis
- Point: un électron non liant
- Paire de points: une paire d'électrons isolés (paire isolée)
- Ligne: deux électrons partagés (liaison)
Structure de Lewis de NH3 :N: 5 électrons de valence ⇒ a besoin de 3 électrons partagés ⇒ 3 liaisons covalentes
H: 1 électron de valence ⇒ a besoin de 1 électron partagé ⇒ 1 liaison covalente
Structure de Lewis de CO2 :C: 4 électrons de valence ⇒ a besoin de 4 électrons partagés ⇒ 4 liaisons covalentes
O: 6 électrons de valence ⇒ a besoin de 2 électrons partagés ⇒ 2 liaisons covalentes
Comment rédiger des structures de Lewis :
- Comptez le nombre total d'électrons de valence. Ajoutez ou soustrayez des électrons si vous avez une charge négative ou positive
- Déterminez le nombre de liaisons covalentes / paires d'électrons isolés que la molécule aura en divisant le nombre d'électrons de valence par 2. Utilisez la formule moléculaire pour dessiner la structure squelettique
- Distribuez les électrons de valence restants pour satisfaire la règle de l'octet, en complétant d'abord l'octet des atomes les plus électronégatifs. Inclure des liaisons doubles ou triples si nécessaire
- Vérifiez le nombre d'électrons de valence dans la molécule dessinée
- Attribuez des charges formelles à tous les atomes
Dessinez une structure de Lewis pour le méthanol CH3OH
Comptez les électrons de valence :
1 C x 4 e- + 4 H x 1 e- + 1 O x 6 e- = 14 électrons de valence ⇒ 7 liaisons et paires d'électrons isolésDisposez les atomes
Ajoutez les liaisons ...
5 liaisons ⇒ 10 électrons
... puis les paires isolées
5 liaisons + 2 paires isolées ⇒ 14 e-
Représentations abrégées.
Les méthodes abrégées sont utilisées pour abréger la structure des molécules organiques. Les 2 principaux types de représentations abrégées sont :
Structure condensée :
- La chaîne principale de carbone est écrite horizontalement. Les atomes sont dessinés à côté des atomes auxquels ils sont liés.
- Les liaisons covalentes et les paires libres sont omises.
- Des parenthèses sont utilisées autour des groupes similaires liés au même atome. Si différents substituants sont liés au même atome, des lignes verticales peuvent être utilisées.
Structure squelettique :
- Les atomes de carbone ne sont pas montrés : on suppose qu'un carbone est à la jonction de 2 lignes et à l'extrémité de n'importe quelle ligne.
- Les hydrogènes autour de chaque carbone ne sont pas dessinés, mais on suppose qu'il y a suffisamment d'hydrogènes pour que les carbones respectent la règle de l'octet.
- Tous les hétéroatomes sont dessinés ainsi que les hydrogènes qui leur sont directement liés.
Vérifiez vos connaissances sur ce chapitre
Le nombre de neutrons dans un atome est égal au nombre de masse (A) de l'atome moins le nombre de protons (Z)
#Le nombre d'électrons dans un atome est égal au nombre de protons (Z) moins la charge de l'atome.
Non, le nombre de protons détermine l'élément et est donc spécifique à un élément et le détermine. Le nombre de masse (A) d'un élément peut être différent. C'est le cas entre 2 isotopes
Un orbitale atomique peut contenir un maximum de 2 électrons. Ainsi :
- Sous-couche s : 1 orbitale s ⇒ 2 électrons
- Sous-couche p : 3 orbitales p ⇒ 6 électrons
- Sous-couche d : 5 orbitales d ⇒ 10 électrons
- Sous-couche f : 7 orbitales f ⇒ 14 électrons
L'ordre des énergies orbitales est le suivant: 1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s ... Vous pouvez facilement vous souvenir de cet ordre en utilisant le mnémonique de droite:
La règle de l'octet stipule que les atomes ont tendance à former des molécules de manière à atteindre un octet dans la couche de valence et à obtenir une configuration de gaz noble. La règle de l'octet s'applique à presque tous les composés constitués d'éléments de la deuxième période.
La liaison est un processus de jonction de 2 atomes qui entraîne une diminution de l'énergie et une augmentation de la stabilité : les atomes obtiennent une couche externe complète d'électrons de valence. Il existe 2 types principaux de liaisons : les liaisons ioniques et les liaisons covalentes.
- Les liaisons ioniques sont basées sur l'attraction électrostatique forte entre deux ions de charges opposées. Ces liaisons résultent du transfert d'électrons d'un élément à un autre afin de respecter la règle de l'octet
- Les liaisons covalentes sont des liaisons avec 2 électrons. Ces liaisons résultent du partage d'électrons entre deux atomes (surtout ceux dans le milieu du tableau périodique). Les électrons sont partagés afin de permettre aux atomes d'atteindre des configurations de gaz nobles
Le nombre attendu de liaisons covalentes autour d'un atome est égal à 8 moins le nombre d'électrons de valence de l'atome
La charge formelle d'un atome est le nombre d'électrons de valence dans l'atome libre moins le nombre d'électrons de valence dans l'atome lié. Le nombre d'électrons de valence dans l'atome lié est égal au nombre d'électrons non liés + nombre d'électrons partagés
Hybridisation est la combinaison de 2 orbitales atomiques ou plus pour former le même nombre d'orbitales hybrides:
- hybridation sp3: la combinaison de 1 orbitale s et 3 orbitales p pour former 4 orbitales hybrides sp3
- hybridation sp2: la combinaison de 1 orbitale s et 2 orbitales p pour former 3 orbitales hybrides sp2
- hybridation sp: la combinaison de 1 orbitale s et 1 orbitale p pour former 2 orbitales hybrides sp
- 2 domaines électroniques → linéaire (angle de liaison: 180 °) → hybridation sp
- 3 domaines électroniques → plan trigonal (angle de liaison: 120 °) → hybridation sp²
- 4 domaines électroniques → tétraédrique (angle de liaison: 109.5 °) → hybridation sp³
Les structures de résonance sont un groupe de structures de Lewis avec le même placement des atomes mais un placement différent de leurs électrons π ou non liants ⇒ leurs liaisons simples restent les mêmes, mais la position de leurs liaisons multiples et de leurs électrons non liants diffère.
Les différents formes de résonance d'une substance ne sont pas toutes égales : la forme avec le plus de liaisons et moins de charges contribue davantage à l'hybride de résonance.
Principes pour déterminer quelle structure de résonance est la plus stable :
- Les charges formelles plus faibles (positives ou négatives) sont préférables aux charges plus élevées
- Les charges formelles sur des atomes adjacents ne sont pas souhaitables
- Une charge formelle plus négative doit se trouver sur un atome plus électronégatif
2 isomères diffèrent par l'arrangement de leurs atomes et électrons, tandis que 2 structures de résonance diffèrent seulement par l'arrangement de leurs électrons.
Une structure de Lewis est une représentation de l'arrangement des atomes et de la position de tous les électrons de valence dans une molécule ou un ion polyatomique. Les paires d'électrons partagés sont représentées par des lignes entre 2 atomes, et les paires isolées sont représentées par des paires de points sur des atomes individuels.
- Comptez le nombre total d'électrons de valence. Ajoutez ou soustrayez des électrons si vous avez une charge positive ou négative
- Déterminez le nombre de liaisons covalentes / paires isolées que la molécule aura en divisant le nombre d'électrons de valence par 2. Utilisez la formule moléculaire pour dessiner la structure squelettique
- Distribuez les électrons de valence restants pour satisfaire la règle de l'octet, en complétant l'octet des atomes les plus électronégatifs en premier. Incluez des liaisons doubles ou triples si nécessaire
- Vérifiez le nombre d'électrons de valence dans la molécule dessinée
- Attribuez des charges formelles à tous les atomes
- La chaîne principale de carbone est écrite horizontalement. Les atomes sont dessinés à côté des atomes auxquels ils sont liés
- Les liaisons covalentes et les paires libres sont omises
- Les parenthèses sont utilisées pour indiquer des groupes similaires liés au même atome. Si différents substituants sont liés au même atome, des lignes verticales peuvent être utilisées
- Les atomes de carbone ne sont pas représentés : on suppose qu'un carbone est au niveau de la jonction de 2 lignes et à l'extrémité de chaque ligne
- Les hydrogènes autour de chaque carbone ne sont pas dessinés, mais nous supposons qu'il y a suffisamment d'hydrogènes pour que les carbones respectent la règle de l'octet
- Tous les hétéroatomes sont représentés ainsi que les hydrogènes liés directement à eux








X: Symbole de l'élément
Z: Numéro atomique = nombre de protons
A: Numéro de masse = nombre de protons + nombre de neutrons