Est-ce que la forme a de l'importance dans la géométrie moléculaire ?
La forme d'une molécule aide à déterminer ses propriétés. Par exemple, le dioxyde de carbone n'est pas soluble dans l'eau car ses molécules linéaires ne s'adaptent pas suffisamment à l'environnement polaire pour se mélanger avec d'autres composés.
Quelle est la différence entre la géométrie moléculaire et la forme moléculaire ?
La structure d'une molécule, en excluant les paires d'électrons sur les atomes centraux. La géométrie décrit comment les agencements électroniques autour de cet atome particulier sont constitués d'autres liaisons ou groupes simples dans sa composition. Les géométries moléculaires de base comprennent :
- Courbé, angulaire ou non-linéaire
- Linéaire
- Octaédrique
- Bipyramide pentagonale
- Voir-Saw ou tétraèdre déformé
- Plan carré
- Pyramide carrée
- En forme de T
- Tétraédrique
- Plan trigonal
- Pyramide trigonale
- Bipyramide trigonale
Qu'est-ce que les motifs de liaison?
Vous remarquerez que les chimistes utilisent couramment des formules génériques pour représenter les motifs de liaison. Ces formules génériques sont connues sous le nom de méthode "AXE".
- "A" représente l'atome central
- "X" représente les paires de liaison
- "E" représente la paire d'électrons isolés
Comment la forme moléculaire affecte-t-elle les propriétés physiques?
La forme d'une molécule a un effet sur sa polarité, qui peut être positive ou négative. Les composés polaires se dissolvent dans des solutions polaires et ont des points d'ébullition plus élevés que les non-polaires; ils fondent également à des températures réduites par rapport à leurs homologues insaturés (qui existent sous forme solide). Pour trouver la forme particulière d'une molécule, vous devez d'abord trouver le nombre stérique.
Qu'est-ce que le nombre stérique en chimie?
Le nombre stérique (souvent abrégé SN, mais à ne pas confondre avec "SN" qui signifie "substitution nucléophile") est la somme du nombre d'atomes liés et du nombre de paires d'électrons isolées. La théorie VSEPR (répulsion des paires d'électrons de la couche de valence) utilise le nombre stérique pour déterminer la géométrie moléculaire.
Comment trouver le nombre stérique?
Pour trouver le nombre stérique, vous devez d'abord utiliser la structure de Lewis. Par exemple, la forme moléculaire AX5 a un nombre stérique de 5 et est trigonale bipyramidale. Cela signifie qu'elle a 5 atomes liés à l'atome central. Voici un tableau de référence rapide pour vous aider à comparer les différences entre les nombres stériques et comment ils affectent la forme moléculaire:
Nombres stériques
| Numéro stérique (SN) | Angle de liaison idéal | Forme | Paires isolées (E) | Paires d'électrons liantes (X) | Polaire / Non polaire | Exemple |
| 2 (AX2) | 180o | Linéaire | 0 | 2 | Polaire | CO2 |
| 3 (AX3) | 120o | Plan trigonal | 0 | 3 | Non polaire | BF3 |
| 4 (AX4) | 109.5o | Tétraédrique | 0 | 4 | Non polaire | SiH4 |
| 5 (AX5) | 90o | Bipyramidal trigonal | 0 | 5 | Non polaire | PCI5 |
| 6 (AX6) | 90o | Octaédrique | 0 | 6 | Non polaire | SF6 |
1 Paire d'électrons libres
| Nombre stérique (SN) | Angle de liaison idéal | Forme | Paires d'électrons libres (E) | Paires d'électrons de liaison (X) | Polaire/Non polaire | Exemple |
| 3 (AX2E) | <120o | Cintrée | 1 | 2 | Polaire | SO2 |
| 4 (AX3E) | 109.5o | Pyramidal | 1 | 3 | Polaire | NH3 |
| 5 (AX4E) | 120o | Chaise longue | 1 | 4 | Polaire | TeCl4 |
| 6 (AX5E) | 90o | Piramidale carrée | 1 | 5 | Polaire | IF5 |
2 paires d'électrons libres
| Nombre stérique (SN) | Angle de liaison idéal | Forme | Électrons libres (E) | Paires d'électrons de liaison (X) | Polaire/Non polaire | Exemple |
| 3 (AXE2) | 180o | Plan trigonal | 2 | 1 | - | - |
| 4 (AX2E2) | 109,5o | Coudé | 2 | 2 | Polaire | H2O |
| 5 (AX3E2) | 120o | En forme de T | 2 | 3 | Polaire | CIF3 |
| 6 (AX4E2) | 90o | Plan carré | 2 | 4 | Non polaire | XeF4 |
Dans la traduction française de la section précédente :
3 Paires libres d'électrons
| Nombre stérique (SN) | Angle de liaison idéal | Forme | Paires d'électrons libres (E) | Paires d'électrons de liaison (X) | Polaire/Non polaire | Exemple |
| 4 (AXE3) | 180o | Linéaire | - | - | - | - |
| 5 (AX2E3) | 120o | Linéaire | 3 | 2 | Non polaire | I3- |
| 6 (AX3E3) | 180o | T-forme | 3 | 3 | - | - |
4 Paires d'Électrons non liantes
| Numéro Stérique (SN) | Angle de Liaison Idéal | Forme | Paires électroniques non liantes (E) | Paires électroniques de liaison (X) | Polaire/Non polaire | Exemple |
| 5 (AXE4) | 180o | Linéaire | 4 | 1 | - | - |
| 6 (AX2E4) | - | - | 4 | 2 | - | - |
Identifiant la forme moléculaire par le nombre stérique
Une autre méthode pour déterminer la géométrie moléculaire consiste à attribuer la forme d'une molécule en fonction de son nombre stérique.
Par exemple :
SN2 = linéaire
SN3 = plan trigonal
SN4 = tétraédrique
SN5 = bipyramide trigonale
SN6 = octaédrique
Règles de VSEPR
En suivant quelques règles simples pour VSEPR, vous pouvez identifier la forme moléculaire beaucoup plus rapidement :
- Identifiez l'atome central en dessinant la structure de Lewis.
- Comptez le nombre d'électrons de valence et ajoutez un électron pour chaque atome de liaison.
- Ajoutez ou soustrayez des électrons pour la charge.
- Divisez le total de ceux-ci par 2 pour trouver le nombre total de paires d'électrons.
- Utilisez ce nombre pour prédire la forme.
Les molécules peuvent-elles avoir plus d'un atome central ?
Oui. Par exemple, le butane a une forme moléculaire de C4H10. Si nous prenons cette molécule à longue chaîne et la découpons en différentes parties, nous constatons que chacun des atomes de carbone est son propre atome central. Par conséquent, le butane contient 4 atomes centraux.
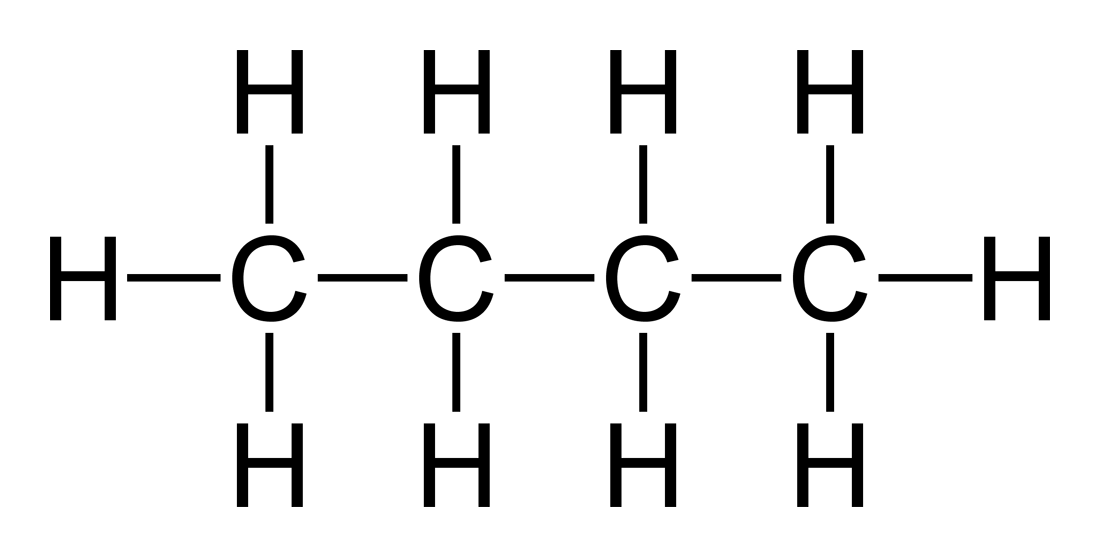
Pourquoi les composés moléculaires diffèrent-ils par leur forme?
La théorie VSEPR (valence shell electron pair repulsion) indique que les électrons chargés négativement se repoussent mutuellement. Les forces qui les poussent à se repousser mutuellement déforment les angles des liaisons, ce qui affecte la forme des molécules. Les formes des molécules dans un composé sont dictées par la théorie VSEPR. Les formes peuvent être linéaires, pyramidales trigonales, tétraédriques, pliées ou une combinaison de ces formes. Les paires d'électrons entourant l'atome central d'une molécule adoptent différentes configurations spatiales les unes par rapport aux autres, ce qui détermine la forme du composé. Cela signifie que les paires d'électrons n'interagissent pas les unes avec les autres, mais qu'elles interagissent avec l'atome central. Cela détermine la forme des molécules dans un composé.
Comment les liaisons multiples affectent-elles la forme d'une molécule?
Les liaisons simples sont plus fortes. Les liaisons doubles et triples se repoussent mutuellement de manière plus forte. La polarité des molécules détermine leur polarité et leur structure. Les liaisons polaires et les moments dipolaires négatifs des molécules déterminent leur polarité.
Comment le remplacement d'une liaison par une liaison double ou triple affecte-t-il la forme des molécules?
Dans la théorie VSEPR, plus il y a de liaisons autour des électrons centraux d'un atome dans une liaison chimique, plus il y a de distorsion dans les angles de liaison. En essence, les liaisons multiples prennent simplement plus d'espace, tout comme les paires d'électrons.